A regulamentação da Lei de Pesquisa Clínica e os próximos passos
Em 8 de outubro de 2025, entrou em vigor o Decreto nº 12.651/2025, que regulamenta a Lei nº 14.874/2024 e institui o Sistema Nacional de Ética em Pesquisa com Seres Humanos (SNEP). A norma consolida diretrizes para a aprovação ética, a governança e o credenciamento de Comitês de Ética em Pesquisa (CEPs), trazendo maior segurança jurídica ao setor.
Alguns temas que estão na Lei nº 14.874/2024 não estão tratados com profundidade no Decreto e precisarão de maior detalhamento, tais como: diretrizes complementares sobre o fornecimento pós-estudo; a existência de um cadastro nacional de pesquisas clínicas; biobanco e biorrepositórios, todos temas que serão tratados após estabelecida a Instância Nacional de Ética em Pesquisa (INAEP).
A instituição do Sistema Nacional e sua composição multidisciplinar
Entre os pontos de destaque, no Decreto temos a estruturação do Sistema Nacional de Ética em Pesquisa com Seres Humanos, com duas instâncias.
- Instância Nacional de Ética em Pesquisa (INAEP): órgão colegiado vinculado ao MS, com funções normativa, fiscalizadora e recursal.
- Instância de Análise Ética: representada pelos CEPs, com caráter consultivo e deliberativo e que atuarão de forma independente e autônoma, analisando e aprovando protocolos e monitorando a execução desses estudos.
A composição multidisciplinar da Instância Nacional, que contará com 33 membros, é um ponto positivo, principalmente pela previsão de 15 especialistas com notório saber e atuação relevante na área de ética em pesquisa com seres humanos, a serem selecionados:
- Por processo seletivo público, com critérios de representatividade regional, étnico-racial, de gênero e interdisciplinar;
- Ter doutorado ou, no mínimo, dez anos de experiência em comitês de ética em pesquisa com seres humanos ou na elaboração, análise e condução de protocolos de pesquisa com pessoas.
- Para mandato de 3 anos, com possibilidade de recondução mediante avaliação de desempenho.
Credenciamento e Acreditação dos CEPs: Formalização e Escopo Ético
Existirão dois níveis de Comitês de Ética em Pesquisa (CEPs):
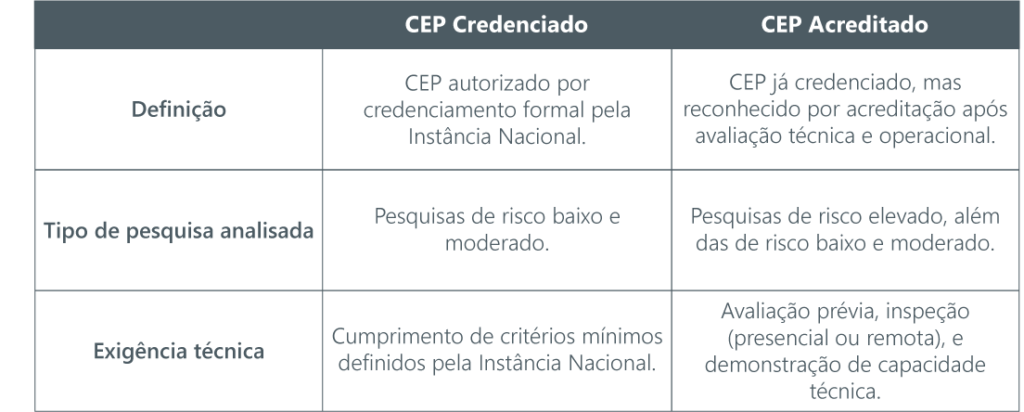
Essa classificação será disciplinada pela INAEP, podendo incluir inspeções presenciais ou remotas, e será regida por critérios objetivos, com possibilidade de priorização em razão de interesse público ou de emergência sanitária.
Classificação de risco multidimensional
A análise ética das pesquisas será orientada por uma classificação de risco multidimensional e será essencial para definir o tipo de CEP competente para a análise e os procedimentos aplicáveis.
Os critérios para classificação do grau de risco incluem a natureza da intervenção ou procedimento; o grau de invasividade e potencial de dano ao participante; a população envolvida, com atenção especial a grupos vulneráveis (crianças, gestantes, indígenas, privados de liberdade, pessoas com deficiência); o uso de tecnologias emergentes, dados sensíveis ou inteligência artificial em saúde; incerteza científica quanto aos efeitos do objeto de estudo; os benefícios diretos ao participante e à coletividade; a complexidade metodológica do estudo; o estágio de desenvolvimento clínico do produto ou tecnologia; a multicentricidade ou internacionalização da pesquisa.
A depender da classificação, poderão ser adotados procedimentos simplificados para protocolo, análise e autorização, e a tramitação dos protocolos será diferenciada conforme a gradação de risco.
Fornecimento Pós-Estudo: Garantia de Continuidade Terapêutica
A regulamentação do acesso pós-estudo está mencionada no decreto, porém a regulamentação do tema sobre elaboração, apresentação e análise ética dos planos e programas de fornecimento pós-estudo ainda será criada pela INAEP.

O patrocinador deve garantir o fornecimento gratuito do produto investigacional após o término do ensaio clínico, sempre que este for considerado a melhor alternativa terapêutica.
Prioridade para Pesquisas Estratégicas ao SUS
O Decreto prevê mecanismos para dar celeridade à análise ética de estudos considerados estratégicos para o SUS, inovação tecnológica e resposta a emergências sanitárias, que terão tramitação prioritária, com prazo máximo de 15 dias para avaliação ética.
Plataforma Nacional de Pesquisas com Seres Humanos
O Decreto regulamenta a criação de uma plataforma eletrônica integrada, que será mantida pelo Ministério da Saúde e terá as seguintes funcionalidades:
- Cadastro de pesquisas e voluntários;
- Submissão e acompanhamento eletrônico de documentos;
- Comunicação segura entre patrocinadores, pesquisadores e órgãos reguladores;
- Proteção de dados sensíveis e segredos industriais;
- Base pública de dados atualizada e acessível.
Essa centralização representa um avanço importante na eficiência regulatória, na transparência e na segurança jurídica dos estudos clínicos no país.
Próximos Passos: Implementação e Normatização
O Decreto prevê a criação de um grupo de trabalho temporário, com duração inicial de três meses, coordenado pela Secretaria de Ciência, Tecnologia e Inovação do Ministério da Saúde. Esse grupo será responsável por:
- Elaborar o regimento interno da Instância Nacional;
- Propor normas complementares sobre credenciamento, biobancos, grupos vulneráveis, ciências humanas, entre outros;
- Procedimentos para avaliação ética integrada com a Anvisa; e
- Apresentar relatório técnico com justificativas das propostas.
Enquanto isso, permanecem válidas as normas do Conselho Nacional de Saúde que não contrariem a Lei ou o Decreto. Além disso, CEPs já credenciados e acreditados no atual sistema mantêm esse status até que haja futura avaliação pela INAEP.
A regulamentação chegou, mas o sistema ainda está em construção. Nosso time de Life Sciences acompanhará de perto os próximos avanços nos processos em direção e preparação para um ambiente ético mais estruturado, exigente e transparente.
A equipe de Life Sciences & Healthcare do Souto Correa está disponível caso tenha qualquer dúvida sobre os temas e seus possíveis desdobramentos através do e-mail: lifesciences@soutocorrea.com.br.
