CMED publica novo marco regulatório para a precificação de medicamentos no Brasil
Em 24 de dezembro de 2025, a CMED publicou no Diário Oficial da União a Resolução 3/2025, para dispor sobre os critérios para definição de preços de produtos novos e novas apresentações de medicamentos, de que trata o art. 7º da Lei 10.742/2003, e sobre o procedimento para a apresentação de Documento Informativo de Preço (“DIP”). A Resolução 3/2025 revoga a Resolução 2/2004, editada há mais de duas décadas, com regras voltadas aos medicamentos sintéticos, e que, portanto, não contemplavam a realidade dos medicamentos biológicos e biossimilares, por exemplo. As novas regras da Resolução 3/2025 passam a valer a partir de 29 de abril de 2026, tendo em vista que a Resolução em comento foi republicada em 30 de dezembro de 2025, pois não havia sido assinada pelo Ministro da Saúde. O texto da norma não foi alterado, apenas o início de sua vigência foi postergado em 6 dias por conta de sua republicação.
O texto final da Resolução 3/2025 pode ser acessado neste link.
Principais novidades do novo marco regulatório
A Resolução 3/2025:
- Traz novas categorias de enquadramento dos medicamentos com diferentes critérios para obtenção do Preço Fábrica (“PF”);
- Amplia a cesta de Países utilizada para o referenciamento externo de preços – o novo marco exclui da cesta de Países a Nova Zelândia e acrescenta 5 (cinco) Países: África do Sul, Japão, México, Noruega, e Reino Unido;
- Amplia o conceito de preço provisório;
- Vincula a publicação do registro sanitário à submissão do pedido de preço (ou a fixação de preço provisório de ofício);
- Trata da esperada inovação incremental; e
- Confere maior previsibilidade para o preço de medicamentos biossimilares.
Por outro lado, os critérios de precificação de terapias avançadas e produtos radiofármacos serão tratados em resolução específica, e por ora tais produtos serão considerados casos omissos. Além disso, os critérios para reajuste extraordinário de preços de medicamentos não foram contemplados no novo marco e a expectativa é que sejam definidos em 2026.
A Resolução prevê um período de transição de 120 (cento e vinte dias) e, durante esse intervalo, o Secretário-Executivo da CMED, Mateus Amâncio, afirmou que a CMED “atuará para esclarecer dúvidas e oferecer a orientação necessária para uma implementação segura e transparente das novas regras”.
i. Disposições preliminares do novo marco
A Resolução 3/2025 normatizou o conceito de inovação incremental como sendo aquela alteração em relação a medicamento originador decorrente de atividade inovativa, não se admitindo como tal a mera variação de características simples do produto, tais como:
(i) Mudanças puramente estéticas do produto;
(ii) Mudanças rotineiras ou insignificantes nas funções ou características do produto que não envolvam um grau suficiente de novidade ou de esforço tecnológico, e que não acrescentem nada significativo ao seu desempenho;
(iii) Mudanças no nome do produto ou no tamanho ou volume da embalagem;
(iv) Comercialização ou fabricação de produtos novos integralmente desenvolvidos e produzidos por outra empresa; ou
v) Customização para um cliente que não inclua diferenças significativas de atributos comparados aos produtos registrados por outras empresas no País.
Nesse sentido, o novo marco também trouxe o conceito de medicamento com inovação incremental como sendo aquele medicamento que demonstre atividade inovativa em relação a um medicamento originador já registrado no País, consistindo em nova associação, nova monodroga, nova via de administração, nova concentração, nova forma farmacêutica, novo acondicionamento ou inovação incremental diversa, conforme definições:
(i) Nova associação: medicamento com uma nova combinação no País, de dois ou mais Insumos Farmacêuticos Ativos – IFAs de medicamentos já registrados e ativos no banco de dados da CMED, incluindo as combinações em doses fixas;
(ii) Nova monodroga: medicamento com somente um Insumo Farmacêutico Ativo (IFA) de uma associação que foi registrada anteriormente no País e está ativa no banco de dados da CMED;
(iii) Nova via de administração: medicamento com uma nova via de administração no País que possua mesma forma farmacêutica, mesma concentração e mesma indicação terapêutica em relação a um medicamento originador, atualmente ativo no banco de dados da CMED;
(iv) Nova concentração: medicamento com uma nova concentração no País que possua mesma forma farmacêutica em relação a um medicamento originador, atualmente ativo no banco de dados da CMED;
(v) Nova forma farmacêutica: medicamento com uma nova forma farmacêutica no País em relação a um medicamento originador, atualmente ativo no banco de dados da CMED;
(vi) Novo acondicionamento: medicamento com novo acondicionamento no País que possua mesma forma farmacêutica, mesma concentração e mesma indicação terapêutica em relação a um medicamento originador, atualmente ativo no banco de dados da CMED; e
(vii) Inovação incremental diversa: medicamento com inovações incrementais diversas daquelas do conceito de medicamento com inovação incremental em relação a um medicamento originador já registrado no País, incluindo novo dispositivo de administração.
ii. Nova ordem cronológica para submissões de preço
O novo marco determina que as empresas titulares do registro sanitário deverão submeter pedido de preço à CMED após a submissão do pedido de registro e antes da sua publicação. Será responsabilidade da empresa acompanhar o trâmite do processo de registro junto à Anvisa e adotar as providências necessárias ao cumprimento do art. 6º da Resolução 3/2025. Se a titular do registro sanitário não apresentar o DIP até a publicação pela Anvisa, a CMED deverá instaurar procedimento de ofício para definição do Preço Fábrica (PF) do medicamento.
iii. Reunião de pré-submissão
A Resolução 3/2025 prevê que os interessados podem solicitar reunião de pré-submissão com a CMED para apresentação do DIP.
iv. Critérios para determinação do preço
A Resolução 3/2025 prevê os seguintes critérios para determinação do preço:
- Referenciamento externo de preços: O PF proposto pela empresa não poderá ser superior ao menor PF praticado para o mesmo produto nos Países de referência, agregando-se os impostos incidentes.
- 14 (catorze) Países de referência, a chamada “cesta de Países” ou “Países da cesta”: África do Sul, Alemanha, Austrália, Canadá, Espanha, Estados Unidos da América, França, Grécia, Itália, Japão, México, Noruega, Portugal e Reino Unido, além do País de origem do produto.
- O novo marco exclui da cesta de Países a Nova Zelândia e acrescenta 5 (cinco) Países: África do Sul, Japão, México, Noruega e Reino Unido.
- Preço definitivo e preço provisório:
- Para que o PF seja apurado, o produto deve estar sendo comercializado em pelo menos 4 (quatro) Países da cesta, cujas fontes de preço estejam publicamente disponíveis para consulta;
- Caso o produto não esteja sendo comercializado em pelo menos 4 (quatro) Países da cesta, a CMED estabelecerá preço provisório ao produto, devendo a empresa apresentar à CMED, com periodicidade de um ano, documento que comprove o lançamento do produto, com respectivo preço, nos Países de referência;
- A condição de provisoriedade não se aplica aos produtos novos desenvolvidos e fabricados no Brasil;
- Para a conversão do preço expresso em moeda estrangeira para a moeda corrente nacional, será utilizada a taxa média de câmbio de venda, divulgada pelo Banco Central do Brasil, do período de sessenta dias úteis anteriores à data de aprovação do Parecer Técnico pela CMED ou à data da decisão em sede recursal, conforme o caso;
- A empresa poderá solicitar, até a decisão de primeira instância da CMED, a atualização do preço pleiteado em caso de apreciação ou depreciação cambial expressiva, sem prejuízo do prazo de análise.
v. Categorias de medicamentos e critérios para definição do PF por categoria
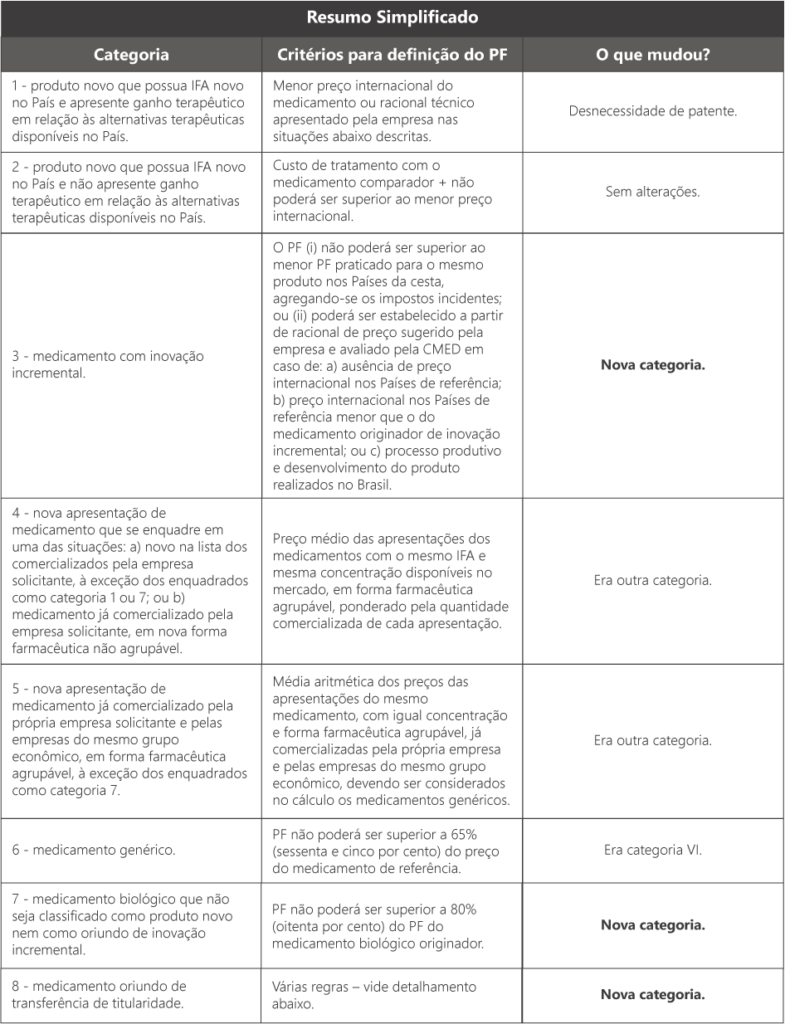
A tabela abaixo simplifica as categorias de medicamentos previstas no novo marco e os respectivos critérios para definição do PF por categoria, sem prejuízo do detalhamento contido ao longo do texto:
O novo marco prevê 8 (oito) categorias de enquadramento dos produtos novos, a saber:
- Categoria 1: produto novo que possua IFA novo no País e apresente ganho terapêutico em relação às alternativas terapêuticas disponíveis no País. Não se exige mais patente da molécula para enquadramento nesta categoria, como era previsto na Res. 2/2004. As novas apresentações de medicamentos classificados na Categoria 1 que venham a ser lançadas posteriormente no mercado seguirão, durante o período de 5 (cinco anos), a mesma categorização.
- Categoria 2: produto novo que possua IFA novo no País e não apresente ganho terapêutico em relação às alternativas terapêuticas disponíveis no País.
- Categoria 3: medicamento com inovação incremental, conforme os seguintes tipos: a) nova associação; b) nova monodroga; c) nova via de administração; d) nova concentração; e) nova forma farmacêutica; f) novo acondicionamento; ou g) inovação incremental diversa;
- Categoria 4: nova apresentação de medicamento que se enquadre em uma das situações: a) novo na lista dos comercializados pela empresa solicitante, à exceção dos enquadrados como categoria 1 ou 7; ou b) medicamento já comercializado pela empresa solicitante, em nova forma farmacêutica não agrupável;
- Categoria 5: nova apresentação de medicamento já comercializado pela própria empresa solicitante e pelas empresas do mesmo grupo econômico, em forma farmacêutica agrupável, à exceção dos enquadrados como categoria 7;
- Categoria 6: medicamento genérico;
- Categoria 7: medicamento biológico que não seja classificado como produto novo nem como oriundo de inovação incremental. Os biossimilares estão enquadrados nesta categoria;
- Categoria 8: medicamento oriundo de transferência de titularidade.
Esta obrigação foi inserida na norma para cumprimento do que foi determinado pelo Supremo Tribunal Federal no âmbito do Tema 1234.
Para detalhar a tabela acima, a Resolução 3/2025 previu os seguintes critérios para definição do PF:
- Categoria 1: menor preço internacional do medicamento ou racional técnico apresentado pela empresa, a ser avaliado pela CMED nas seguintes situações: (i) ausência de preço internacional nos Países da cesta; ou (ii) processo produtivo e desenvolvimento do produto realizados no Brasil. Neste último caso, a CMED deverá considerar, entre outros elementos, o grau de benefício adicional aportado pelo medicamento e o grau de atividade inovativa empreendida pela empresa no País para o desenvolvimento e produção do medicamento pleiteado.
- Categoria 2: custo de tratamento com o medicamento comparador, não podendo ser superior ao menor preço praticado dentre os Países de referência. Neste caso, o custo de tratamento com o produto classificado na Categoria 2 não poderá ser superior ao custo de tratamento com o medicamento escolhido como comparador.
- Categoria 3: O PF (i) não poderá ser superior ao menor PF praticado para o mesmo produto nos Países de referência, agregando-se os impostos incidentes; ou (ii) poderá ser estabelecido a partir de racional de preço sugerido pela empresa e avaliado pela CMED, nas seguintes situações: a) ausência de preço internacional nos Países de referência; b) preço internacional nos Países de referência menor do que o do medicamento originador de inovação incremental; ou c) processo produtivo e desenvolvimento do produto realizados no Brasil. O PF de medicamento com inovação incremental não poderá ser inferior ao PF do medicamento originador de inovação incremental.
- Categoria 4: o PF será definido com base no preço médio das apresentações dos medicamentos com o mesmo IFA e mesma concentração disponíveis no mercado, em forma farmacêutica agrupável, ponderado pela quantidade comercializada de cada apresentação, com base no seguinte: (i) a média ponderada deverá ser calculada com base nas apresentações de igual concentração e forma farmacêutica agrupável existentes no mercado, desde que as formas agrupáveis não apresentem posologia diversa; e (ii) não existindo apresentações com igual concentração, a média ponderada deverá ser calculada com base em todas as apresentações de mesmo IFA e forma farmacêutica agrupável existentes no mercado, seguindo o critério da proporcionalidade direta da concentração de IFA, desde que as formas agrupáveis não apresentem posologia diversa.
- Categoria 5: o PF será definido com base na média aritmética dos preços das apresentações do mesmo medicamento, com igual concentração e forma farmacêutica agrupável, já comercializadas pela própria empresa e pelas empresas do mesmo grupo econômico, devendo ser considerados no cálculo os medicamentos genéricos.
- Categoria 6: o PF não poderá ser superior a 65% (sessenta e cinco por cento) do preço do medicamento de referência. O PF será apurado considerando o PF permitido para o medicamento de referência fixado ao tempo de seu ingresso no mercado nacional, atualizado por meio da aplicação dos índices de ajuste anual permitidos pela Lei 10.742/2003.
- Categoria 7: O PF permitido não poderá ser superior a 80% (oitenta por cento) do PF do medicamento biológico originador. O PF permitido será definido seguindo o critério da proporcionalidade direta da concentração de IFA do medicamento originador, quando inexistir medicamento originador de igual concentração, aplicando-se deságio de 20% (vinte por cento).
- Categoria 8: o PF será definido de acordo com os seguintes critérios: (i) caso a empresa sucessora não possua em seu portfólio apresentação de medicamento com mesmo IFA, concentração e forma farmacêutica agrupável, o preço da apresentação do medicamento que tenha a titularidade de registro transferida não poderá ser superior ao PF da apresentação da antiga detentora do registro; (ii) caso a empresa sucessora já possua em seu portfólio apresentação de medicamento com mesmo IFA, concentração e forma farmacêutica agrupável, o PF permitido não poderá ser superior à média aritmética dos preços das respectivas apresentações dos medicamentos da atual detentora, devendo ser considerados no cálculo os medicamentos genéricos, e nem ao PF da apresentação da antiga detentora do registro. Caso se trate de transferência de titularidade de medicamento genérico, somente serão considerados no cálculo as apresentações de medicamento genérico. Caso se trate de transferência de titularidade de medicamento de referência, somente serão consideradas no cálculo as apresentações do medicamento de referência. Não será concedido ajuste retroativo de preço, salvo quando a apresentação da empresa sucedida estiver inativada no banco de dados da CMED, fazendo jus à nova detentora aos ajustes compreendidos após a data de inativação.
vi. Registro sanitário condicionado à complementação de dados e provas adicionais e preço provisório
A CMED poderá estabelecer preço provisório nos casos de registro condicionado à complementação de dados e provas adicionais após a concessão do registro, quando as informações necessárias para a precificação definitiva do produto ainda não estiverem disponíveis ao tempo da submissão do DIP.
Neste caso:
- A decisão da CMED deverá especificar os dados e provas adicionais cuja apresentação será considerada indispensável para a fixação do preço definitivo; ou
- A CMED poderá decidir pela necessidade de aguardar o cumprimento integral do termo de compromisso firmado com a Anvisa para que seja estabelecido o preço definitivo;
- Até que seja estabelecido o preço definitivo, a empresa deverá apresentar à CMED o Relatório Técnico com dados de evidência de eficácia e segurança do produto sempre que forem apresentados à área de registro da Anvisa, de acordo com o cronograma previsto no Termo de Compromisso firmado para registro do produto;
- A CMED deverá estabelecer preço definitivo para estes produtos no prazo de 90 (noventa) dias, contados da data de cumprimento da integralidade dos compromissos assumidos com a Anvisa ou da data em que forem entregues as informações especificadas na decisão da CMED. Caso a CMED não se pronuncie neste prazo, o medicamento deverá ser comercializado pelo preço provisório até a comunicação da decisão.
vii. Documentos em língua estrangeira
Os documentos que acompanham o DIP devem ser apresentados em língua portuguesa, mas o novo marco também dispõe que serão aceitos documentos nos idiomas inglês e espanhol.
Caso seja necessária a tradução de documentos originalmente enviados nos idiomas inglês e espanhol, será encaminhada diligência solicitando o envio da tradução dos documentos. Quando necessária a tradução, na ausência de norma específica que exija tradução na versão juramentada, poderá ser aceita tradução livre.
Os documentos que acompanham o DIP, quando apresentados em idioma diferente do português, inglês ou espanhol, deverão ser apresentados por meio de tradução juramentada referente à identificação do preço ou à ausência de preço nos países de referência.
viii. Decisão em 1ª instância e prazos
Compete à Secretaria-Executiva da CMED (SCMED) decidir em 1ª instância sobre os pedidos de preços de produtos novos e de novas apresentações submetidos, devendo observar os seguintes prazos, contados da data da publicação do registro:
- Até 60 (sessenta) dias para os produtos classificados nas categorias 4, 5, 6, 7 e 8; e
- Até 90 (noventa) dias para os produtos classificados nas categorias 1, 2 e 3 ou como caso omisso.
Esses prazos poderão ser dilatados, uma única vez e pelo mesmo período. Além disso, a SCMED deverá priorizar a análise de DIPs sempre que houver solicitação formal do Ministério da Saúde, devidamente motivada.
ix. Recurso Administrativo
Da decisão da SCMED caberá recurso ao Comitê Técnico-Executivo (CTE), no prazo de 30 (trinta) dias, contado a partir da intimação da decisão. O recurso será dirigido à SCMED, que poderá reconsiderar a decisão emitida em 1ª instância no prazo de 90 (noventa) dias.
Não havendo reconsideração da decisão ou decorrido o prazo de reconsideração, o processo será enviado ao CTE para julgamento do recurso.
Quando a decisão da SCMED, em sede de reconsideração acolher apenas em parte as razões do recurso, a empresa será intimada para que, querendo, apresente recurso ao CTE, no prazo de 30 (trinta) dias a partir da notificação.
x. Reexame necessário
Estarão sujeitas ao reexame necessário pelo CTE, quando não houver interposição de recurso pela empresa, as decisões proferidas pela SCMED:
- Em casos omissos, ressalvadas as situações amparadas em enunciado do CTE; e
- Quando o PF máximo permitido para o medicamento for definido com base no art. 16[1] (categoria 1 com base no racional de preço sugerido pela empresa), no inciso II do art. 18[2] (categoria 3 com base no racional de preço sugerido pela empresa), ou no art. 19[3] (categoria 3 quando o medicamento aporte benefício adicional, tenha processo produtivo e desenvolvimento realizados no Brasil; e insira-se em mercado relevante com Índice Herfindahl Hirschman – IHH abaixo de dois mil e quinhentos, calculado com base no IFA e considerando-se apenas empresas de grupos econômicos distintos).
[1] Art. 16. A CMED poderá estabelecer PF máximo para produtos classificados na Categoria 1 com base em racional de preço sugerido pela empresa, a ser avaliado pela CMED, nas seguintes situações: I – ausência de preço internacional nos Países de referência; ou II – processo produtivo e desenvolvimento do produto realizados no Brasil.
[2] Art. 18. O PF permitido para o produto classificado na Categoria 3 que demonstrar, com evidências científicas ou racional técnico da empresa, benefício adicional, deverá observar os seguintes critérios: (…) II – poderá ser estabelecido a partir de racional de preço sugerido pela empresa e avaliado pela CMED, nas seguintes situações: a) ausência de preço internacional nos Países de referência; b) preço internacional nos Países de referência menor que o do medicamento originador de inovação incremental; ou c) processo produtivo e desenvolvimento do produto realizados no Brasil.
[3] Art. 19. O PF será estabelecido com base em indicação da empresa proponente quando o medicamento, classificado na Categoria 3: I – aporte benefício adicional; II – tenha processo produtivo e desenvolvimento realizados no Brasil; e III – insira-se em mercado relevante com Índice Herfindahl Hirschman – IHH abaixo de dois mil e quinhentos, calculado por IFA e considerando-se apenas empresas de grupos econômicos distintos.
A decisão do CTE em reexame necessário poderá confirmar a decisão de 1ª instância ou modificá-la, para estabelecer preço superior ou inferior ao apurado pela SCMED.
Nas situações em que do reexame necessário resultar a definição de preço inferior ao estabelecido pela SCMED, caberá pedido de reconsideração ao próprio CTE, com efeito devolutivo, no prazo de 30 (trinta) dias, que será sorteado a novo relator.
A CMED poderá rever suas decisões, quando identificar:
- A qualquer tempo: (i) erro ou imprecisão em uma informação apresentada pela empresa solicitante, quando comprovada a má-fé, sem prejuízo das eventuais sanções aplicáveis; ou (ii) inexatidão material ou erros de cálculo, de ofício ou mediante requerimento da parte;
- Erro na avaliação da documentação, em qualquer de suas instâncias decisórias, por meio de autotutela, no prazo de cinco anos, contados do início da comercialização.
xi. Divulgação dos preços
As decisões proferidas pela CMED em DIP, em qualquer instância, acarretarão a divulgação dos preços aprovados em lista publicada mensalmente em seu sítio eletrônico, no Portal da Anvisa, podendo sofrer alteração em caso de modificação da decisão em sede de reconsideração ou recurso.
A lista de preços publicada no Portal da Anvisa incluirá sinalização dos casos pendentes de julgamento pela CMED.
xii. Disposições finais e transitórias
O PF, obtido a partir dos cálculos previstos no novo marco, será expresso com duas casas decimais com arredondamento a partir da terceira casa decimal, conforme disposto no item “7. Arredondamento de Dado Numérico” da publicação “Normas de Apresentação Tabular” da Fundação Instituto Brasileiro de Geografia e Estatística (IBGE).
O descumprimento do disposto na Resolução 3/2025 sujeitará o infrator às sanções previstas na Lei 10.742/2003.
As dúvidas surgidas na aplicação da Resolução 3/2025 serão dirimidas pelo CTE, ouvida a SCMED.
xiii. Revisão quinquenal do novo marco de precificação de medicamentos
O CTE coordenará, periodicamente, processos de avaliação da Resolução 3/2025, observadas as boas práticas regulatórias, para avaliar a necessidade de sua alteração pelo Conselho de Ministros. Os processos de avaliação serão feitos em periodicidade não superior a 5 (cinco) anos.
xiv. Casos omissos: terapias avançadas e produtos radiofármacos:
Os critérios para definição de preços dos produtos de terapia avançada e dos produtos radiofármacos serão disciplinados em atos específicos do Conselho de Ministros.
Dessa forma, os produtos de terapia avançada e os produtos radiofármacos serão considerados casos omissos enquanto não forem editados os atos específicos do Conselho de Ministros.
xv. Regime de transição
O novo marco regulatório de precificação de medicamentos é aplicável:
- Aos processos de análise de DIP pendentes de julgamento em primeira instância na SCMED;
- Aos produtos classificados como casos omissos, que estejam no CTE para julgamento em 1ª instância; e
- Aos produtos que tenham preços provisórios estabelecidos sob a égide da Resolução 2/2004, que ainda não tenham se tornado definitivos.
As empresas solicitantes de preço de medicamento enquadrado nas situações acima deverão apresentar a complementação da documentação exigida pela Resolução 3/2025, em até 30 (trinta) dias a partir de sua entrada em vigor. Nos processos em que não for apresentada a documentação complementar no prazo assinalado, a SCMED deverá notificar a empresa solicitante para que cumpra a determinação no prazo de 30 (trinta) dias. A inobservância do prazo previsto de 30 (trinta) dias acarretará a instauração de procedimento de ofício para definição do PF inicial do medicamento.
Os recursos administrativos e os reexames necessários que estiverem em análise no CTE e os recursos pendentes de julgamento pelo Conselho de Ministros seguirão seu trâmite perante essas instâncias até seu julgamento, observando o regramento disposto na Resolução 2/2004.
xvi. Normas revogadas
Ficam revogadas:
- A Resolução 2/2004;
- A Resolução 4/2005; e
- A Resolução 4/2006.
A equipe de Life Sciences & Healthcare do Souto Correa está disponível caso tenha alguma dúvida sobre o novo marco e precificação de medicamentos, seu período de transição e seus possíveis desdobramentos por meio do e-mail: lifesciences@soutocorrea.com.br.